Interacciones Intermoleculares
Las fuerzas intermoleculares, tambien conocidas como fuerzas de Van de Waals, existen solamente en las sustancias formadas por moleculas y se pueden clasificar en tres tipo:
- Fuerza dipolo-dipolo o de Keeson. Son dipolos permanentes pues por naturaleza poseen los polos positivos y negativos ( la molécula es polar y tiene un momento dipolar distinto de cero).

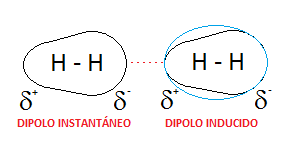
- Fuerza de dispersión de London ( dipolo temporal o inducido). Existen en todas las moléculas, se han polares o no debido a que los electrones están en continuo movimiento y puede suceder que momentáneamente se produzca un dipolo ( la molécula se polariza). Continuamente se están formando y destruyendo estos dipolos temporales. En las moléculas no polares son las únicas fuerzas intermoleculares que existen.

- Fuerzas dipolo-dipolo inducido. Tienen lugar entre una molécula polar y una molécula no polar. En este caso, la carga de una molécula polar provoca una distorsión en la nube electrónica de la molécula no polar y la convierte, de modo transitorio, en un dipolo. En este momento se establece una fuerza de atracción entre las moléculas.
- Uniones puente de hidrógeno. A pesar de su nombre no se trata de una unión química sino de una fuerza intermolecular y es un caso particular de la fuerza dipolo permanente. Para que exista una unión puente de hidrógeno la molécula debe cumplir una condición: que exista un átomo de hidrógeno unido directamente a un átomo muy electronegativo. Las moléculas que presentan la posibilidad de unión puente de hidrógeno presentarán entonces las 3 fuerzas intermoleculares. Es el caso del agua.
Las fuerzas entre las moléculas también pueden ser repulsivas, estas pertenecen las de Pauli a corta distancia y las ion-ion de misma carga.
Además de estas interacciones, las que pueden darse en sustancias puras, existen interacciones entre partículas diferentes, las cuales pueden darse entre:
- Ión-Ión. Se establecen entre iones de diferentes cargas eléctricas.
- Ión y Dipolo permanentemente, como en caso de la solubilidad de un compuesto iónico en agua.
- Dipolo permanente y dipolo inducido. Como en el caso de la solubilidad de un compuesto no polar como dióxido de carbono en agua.
- Hidrofóbicas. Ocurre cuando la molécula en cuestión no es capaz de interaccionar con las moléculas de agua ni por interacciones ión-dipolo ni mediante puentes de hidrógeno.
Fuentes:
Danna Karely Ceja Martinez

WOOOOOW
ResponderEliminar