Interacciones Intramoleculares
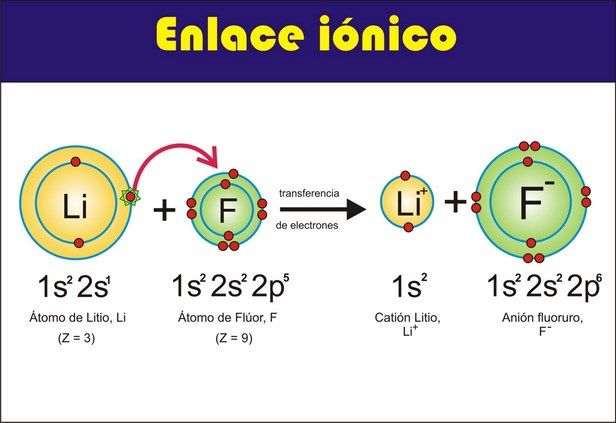
A) Enlace iónico. Es cuando una molécula de una
sustancia contiene átomos de un metal y un no metal los electrones son
atraídos con más fuerza por el no metal, el cual se transforma en
anión; el metal a su vez, se convierte en catión al ceder sus pocos
electrones de valencia, es decir, los iones de diferente signo se atraen
electrostáticamente formando un enlace iónico ya que el átomo
más electronegativo le arranca un electrón de valencia al otro quedando
unidos por la atracción electrostática de los iones.
Este enlace únicamente se forma cuando
la diferencia de electronegatividad es de 2.0 o mayor.
Al formar compuestos iónicos, los elementos a la izquierda
de la tabla periódica por lo general pierden electrones, y forman un catión que
tiene la misma configuración electrónica que el gas noble más cercano.
Este tipo de enlace se caracteriza por ser un enlace débil,
altamente solubles en agua y otros solventes polares, pero insolubles en
solutos no polares, tienen elevada
conductividad térmica y eléctrica y por sus puntos de
fusión y ebullición altos.
B) Enlace covalente. Este tipo de unión se presenta
cuando se comparten uno o más pares de electrones entre dos átomos no
metálicos resultando en una diferencia de electronegatividad pequeña.
Los enlaces covalentes se forman a partir de pares de
electrones y existen diversas formas en las que esto ocurre y dependiendo de
éstas se produce un enlace covalente de diferente tipo. Cuando dos
átomos comparten un par de electrones se forma un enlace covalente
simple. Aunque éste es el enlace más común en los compuestos
covalentes, algunos pueden contener enlaces múltiples: enlaces
dobles, en los que dos átomos comparten dos pares de
electrones, enlaces triples, en la que los átomos comparten
tres pares de electrones y enlace covalente coordinado es cuando el
par de electrones que integran el enlace covalente es donado por un solo
de los átomos enlazados.
Los compuestos covalentes son generalmente líquidos o
gases que contienen moléculas discretas que se atraen ligeramente
entre ellas. sin embargo, los enlaces
covalentes también están presentes en moléculas grandes
tales como el diamantes y en algunos iones.
De igual forma también los enlaces covalentes pueden subclasificarse dependiendo de las electronegatividades que lo forman, siendo:
b.1) Covalente polar. Se establece cuando la diferencia en electronegatividad es mayor a 0.5 pero menor a 2.0, el átomo mas electronegativo atrae en mayor medida a los orbitales que se están enlazando deformando la nube electrónica del enlace y produciendo un momento dipolar, que va desde el átomo parcialmente positivo (δ+) hacia el átomo parcialmente negativo(δ-).
b.2) Covalente no polar. Es cuando se comparten
electrones sin que haya prácticamente ninguna deformación de los orbitales. Se
establece cuando la diferencia de electronegatividad es menor a 0.5 y son los
enlaces más fuertes que existen, un compuesto con covalencia perfecta y 100%
simétrico genera características como la dureza y estabilidad del diamante. Las
propiedades que dependen del grado de covalencia son la estabilidad y falta de
reactividad del compuesto, menor solubilidad en agua y otros solventes polares,
pero mayor solubilidad en solventes no polares, menor conductividad térmica y
eléctrica, y menor punto de fusión y ebullición.
C) Enlace Metálico. Es conocido como modelo
de la nube o del mar de electrones. En este modelo se considera que el
enlace no se da entre átomos, sino mas bien entre
cationes metálicos que están compartiendo un gran numero de
electrones de valencia. Por ejemplo, el sodio es un conjunto ordenado de
iones Na+ y un "mar de electrones" distribuidos entre ellos.
.
|
Recordemos que los átomos de los metales tienen pocos
electrones en su última capa, por lo general 1, 2 ó 3, los cuales pierden
o donan fácilmente y se convierten en iones positivos. Por ejemplo Na+,
Cu+2, Fe+3. Los iones positivos resultantes se ordenan en el espacio
formando la red metálica. Los electrones de valencia desprendidos de los átomos
forman una nube de electrones que puede desplazarse a través de toda la red. De
este modo todo el conjunto de los iones positivos del metal queda unido
mediante la nube de electrones con carga negativa que los envuelve.
Fuentes:


contigo si voy a prender chiquita <3 <3
ResponderEliminar